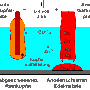
Reinkupfer durch Elektrolyse mit Cu-Elektrod.
Für Diaschau bitte auf Photo clicken
"Kupfer hat wegen seiner hervorragenden Elektrotechnik große Bedeutung. Verunreinigungen setzen jedoch die Leitfähigkeit
stark herab. Deshalb muss Rohkupfer gereinigt (raffiniert) werden.
Durch elektrolytische Raffination stellt man industriell reinstes Kupfer her, indem man "Rohkupfer"
(98,5 %) als Pluspol (Anode) und ein dünnes Blech aus Reinstkupfer als Kathode in einer Kupfersulfat-Lösung elektrolysiert.
Eine Gleichstromquelle entzieht den Kupfer-Atomen an
der Anode Elektronen. Als Cu2+-Ionen gehen sie in Lösung und werden von Kathode angezogen.
Die Elektonen werden zur Kathode "gepumpt" und dort an.Kupfer-Ionen weitergegeben.
(Als Verunreinigung im Rohkupfer vorkommende Edelmetalle (Platin, Gold und Silber) lassen sich nicht oxydieren und sinken unverändert als "Anodenschlamm" zu Boden.)
Im folgenden Modell-Experiment sollst du Kupfersulfatlösung mit 2 Kupfer-Elektroden elektrolysieren.
Material
Experimentiertablett, Reaktionsplatte mit 6 Kammern und 1 Deckel, Batterie (9 Volt), 2 Kabel mit Krokodiklemmen, isolierter Kupferdraht (D = 0,8 mm),
Schere, Waage, verdünnte Kupfer(II)sulfat-Lösung, dest, Wasser, Nagel 10 cm, Toilettenpapier.
Aufgaben
1. Schneide zwei 15 cm lange Stücke von isoliertem Kupferdraht ab. Entferne die Isolierung.
2. Umwickle den Nagel mit den Kupferdrähten, um Gebilde wie in Photo 1 zu erhalten.
3. Wiege sie und notiere die Gewichte.
4. Fülle eine der beiden Kammern von WP6 mit 4 mL verdünnter Kupfersulfat-Lösung.
5. Verschließe die Kammer mit den 2 Elektroden, so dass sie in die Kupfersulfat-Lösung tauchen und sich nicht berühren.
6. Verbinde sie über die Kabel mit der Batterie.
7. Nach etwa 1 Stunde öffne den Deckel, entnimm die Elektroden, spüle sie vorsichtig ab, markiere und trockne sie.
8. Wiege sie erneut und notiere die neuen Gewichte (Photo 3).
Beobachtungen (Photo 3)
1. An der Kathode hat sich ein Kupfer-farbener Belag abgesetzt (etwas fiel herunter).
2. Die Masse der Kathode steigt von 0,63 g auf 0,69 g, die der Anode sinkt von 0,63g auf 0,55g (Photo 3).
Erklärungen
Anodische Oxidation: Cu (unrein) -----> Cu2+ + 2e-
Kathodische Reduktion: Cu2+ + 2e- -----> Cu (rein)
Wanderung der Cu2+-Ionen zur Kathode
 Microscale Family 2013
Microscale Family 2013