Kupfer-Konzentrationszelle
Zur Diaschau bitte auf Photo klicken
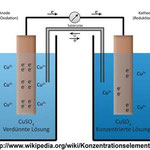
Eine Konzentrationszelle ist eine Galvanische Zelle, deren Halbzellen sich lediglich in der Konzentration des Elektrolyten unterscheiden.
Im folgenden Experiment misst du die Spannung zwischen zwei Kupferelektroden. Beide stehen in Lösungen von
Kupfer(II)sulfat. Die Lösung in der einen Halbzelle hat dabei 1/10 der Konzentration verglichen mit der in der anderen. Für den Ionenfluss sind beide Halbzellen mit einem Docht verbunden, der mit
Kaliumchlorid getränkt ist.
Material
Experimentiertablett, Reaktionsplatte mit 6 Kammern, 2 Kabel mit
Krokodiklemmen, isolierter Kupferdraht (D = 0,8 mm), Schere, digitales Multimeter für Spannungs-messung (Photo 3), Kupfer(II)sulfat-Lösung
(1-molar, 0,1 molar), Kaliumchlorid-Lösung, dest. Wasser, Nagel 10 cm, Toilettenpapier.
Aufgaben
1.
Schneide zwei 15 cm lange Stücke von isoliertem Kupferdraht ab. Entferne die
Isolierung.
2. Umwickle den Nagel mit den Kupferdrähten, um Gebilde wie in Photo 1 zu
erhalten.
3. Verbinde sie über zwei Kabel mit dem auf 20 mV (DC) eingeschalteten Messgerät
(Buchse „COM“ für Minuspol, Buchse „V“ für Pluspol).
4. Fülle benachbarte Kammern der Reaktionsplatte mit je 4 mL 0,1M Kupfersulfat-
Lösung (links) bzw.1M Kupfersulfat-Lösung.
5. Drehe aus einem halben Stück Toilettenpapier einen Docht, tränke ihn vollständig
mit 1M Kaliumchlorid-Lösung.
6. Tauche ihn als Salzbrücke mit einem Ende in die linke Kammer und mit dem
anderen in die rechte.
7. Stelle das Messgerät in den Bereich von 200 mV DC ein.
8. Tauche zunächst einen der aufgedrehten Kupferdrähte in die Kupfersulfatlösun-
gen 0,1M (und dann auch den anderen in die Kammer mit 1,0 M (Photo 3).
Vergleiche deine Beobachtungen mit denen in Photo 3.
Erklärungen
Anodische Oxidation: Cu (unrein) -----> Cu2+ + 2e-
Kathodische Reduktion: Cu2+ + 2e- -----> Cu (rein)
Auf der Seite mit der 0,1 M Kupfersulfat-Lösung wird das Kupfer der Elektrode unter Abgabe von Elektronen zu Kupfer-Ionen
oxidiert. Aufgrund der Elektronenabgabe ist dies die negative Elektrode, der Minuspol. Da hier eine Oxidation erfolgt, ist in einer Galvanischen Zelle der Minuspol die Anode (Oxidations-Elektrode). Die Kupfer-Ionen lösen sich in der verdünnten Lösung. Dabei erhöht sich deren Konzentration in dieser
Halbzelle.
Die abgegebenen Elektronen wandern
freiwillig über den metallischen Leiter und das Messgerät zur positiven Elektrode. Dort reduzieren sie die in zehnfacher Konzentration gelösten Kupfer-Ionen zu elementarem Metall, das sich an
der Elektrode anlagert. Da hier eine Reduktion erfolgt, ist in einer Galvanischen Zelle der Pluspol die Kathode
(Reduktions-Elektrode). Die Kupfer-Ionen-Konzentration sinkt also in dieser Halbzelle.
 Microscale Family 2013
Microscale Family 2013